提问者:一只小熊
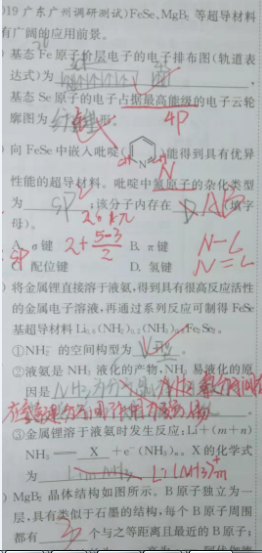
辽宁,2月4日,《高考化学小题狂做基础篇全国卷》p103题一。疑惑:第二问中氮原子的杂化类型怎么算?怎么判断这个化合物中是否存在氢键?⑶②氨分子存在氢键,为什么就容易液化?⑷为什么每个B原子周围都有三个与之等距离且最近的B原子?谢谢老师详细解答。
编辑解答:
1.关于有机物中氮原子的杂化方式:有机物中氮原子形成3个键,含有1个孤对电子,氮原子连接其他原子的个数,加上孤对电子数等于价层电子对数。
若氮原子连接3个原子,价层电子对数为4则为sp3杂化;若连接2个原子,价层电子对数为3,则为sp2杂化;若连有1个原子,价层电子对数为2,则为sp杂化。
2.氢键结合的情况如果写成通式,可用X-H…Y表示。式中X和Y代表F,O,N电负性大而原子半径较小的非金属原子。
X和Y可以是两种相同的元素,也可以是两种不同的元素。也可以理解为氢键一般存在于含有N,O,F原子中,氢键会影响物质的沸点、溶解性等。
3.氨气分子之间可以形成分子间氢键,使得氨气的熔沸点都比较高,所以氨气易液化。
分子内氢键使物质的沸点降低,分子间氢键使物质的沸点升高。
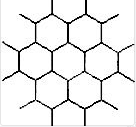
4.石墨晶体的结构如下,石墨晶体中每个碳原子周围有3个等距离且最近的碳原子。由于B原子层具有类似于石墨的结构,所以每个B原子周围都有3个与之等距离且最近的B原子。

微信小程序
微信扫一扫体验

微信公众账号
微信扫一扫加关注
评论 返回
顶部

发表评论 取消回复