综合化学实验(典型例题)
规律总结综合实验题的解题分四步:(1) 巧审题,明确实验的目的和原理。实验原理可从题给的化学情景(或题目所给实验目的)并结合元素化合物等有关知识获取。在此基础上,遵循可靠性、简捷性、安全性的原则,确定符合实验目的和要求的方案。(2) 想过程,理清实验操作的先后顺序。根据实验原理所确定的实验方案中的实验过程,确定实验操作 例 硫代硫酸钠(Na2S2O3)可用作分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2制得。实验室模拟该工业过程的装置如图所示:
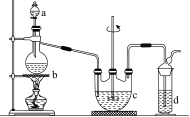
请回答下列问题:
(1) b中反应的离子方程式为________________________________________________________________________,
c中试剂为____________________。
(2) 反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是________。
(3) d中的试的方法步骤,把握各步实验操作的要点,理清实验操作的先后顺序。(3) 看准图,分析各项实验装置的作用。要认真细致地分析图中所示的各项装置,并结合实验目的和原理,确定它们在该实验中的作用。(4) 细分析,得出正确的实验结论。实验现象(或数据)是化学原理的外在表现。在分析实验现象(或数据)的过程中,要善于找出影响实验成败的关键以及产生误差的原因,或从有关数据中归纳出定量公式,绘制变化曲线等。剂为________。
(4) 实验中要控制SO2生成速率,可以采取的措施有__________________________(写出两条)。
(5) 为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是__________________。
【答案】(1) SO3+2H+===SO2↑+H2O或HSO3+H+===SO2↑+H2O 硫化钠和碳酸钠混合溶液 (2) 硫 (3) NaOH溶液 (4) 控制反应温度、调节酸的滴加速率(或调节酸的浓度等) (5) 若SO2过量,溶液显酸性,产物分解
【解析】根据题给反应方程式对题给实验装置分析可知,左侧装置为SO2的发生装置,据此可确定a中为浓硫酸,b中为Na2SO3或NaHSO3,b中反应的离子方程式为SO3+2H+===SO2↑+H2O或HSO3+H+===SO2↑+H2O;c中发生反应:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2,c中试剂为Na2S和Na2CO3的混合溶液;右侧装置为尾气处理装置,主要吸收多余的SO2和c中反应生成的CO2,由此可知,d中试剂选用NaOH溶液;实验中要控制SO2的生成速率,可以采取的措施有:①控制浓硫酸的浓度;②控制浓硫酸的滴加速度;③控制反应的温度等。因Na2S2O3受热、遇酸易分解,为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,是因为过量的SO2将
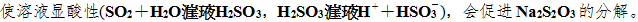



发表评论 取消回复